Khi làm quen với chương trình hóa học, các em học sinh cần phải biết đến bảng tuần hoàn hóa học cùng ghi ghi nhớ chúng. Để giúp các bạn dễ dàng rộng trong quy trình học, VUIHOC mang lại cho những bạn bài viết có các mẹo ghi nhớ bảng tuần trả một cách cụ thể và bí quyết đọc, các định nghĩa cơ bạn dạng để làm bài một cách bao gồm xác.
1. Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn chất hóa học hay nói một cách khác là bảng tuần hoàn Mendeleev, là cách thức dạng bảng hiển thị lên các nguyên tố hóa học sáng tạo vào năm 1869 vày nhà chất hóa học Dimitri Mendeleev fan Nga.
Bạn đang xem: Baảng tuần hoàn hóa học
Bảng tuần trả hóa học biểu thị nguyên tố hóa học theo cách sắp xếp số hiệu nguyên tử của nguyên tố, cấu hình electron cùng quy cơ chế tuần trả khác. Cực hiếm của bảng tuần hoàn chất hóa học là có thể tính toán tính chất hóa học của một nguyên tố dựa vào vị trí của nó.
Bảng tuần hoàn hóa học tương đối đầy đủ nhất sẽ được tổng phù hợp cho chúng ta học sinh nắm rõ. Do vậy hãy theo dõi thật kỹ càng nhé!
2. Cấu trúc của bảng tuần hoàn
2.1. Ô nguyên tố
Ô nguyên tố bộc lộ ra cho bọn họ biết những số hiệu nguyên tử, thương hiệu nguyên tố, ký hiệu hóa học, nguyên tử khối của nhân tố đó. Số hiệu nguyên tử bao gồm số trị bởi số đơn vị chức năng của năng lượng điện hạt nhân và bằng số electron vào nguyên tử. Số hiệu nguyên tử là số trang bị tự của nguyên tố kia ở trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Magie là 12 cho thấy thêm rằng số đơn vị chức năng điện tích hạt nhân là 12, Magie làm việc ô số 12, có 12 electron vào nguyên tử Magie.
2.2. Chu kỳ
Chu kỳ được gọi là dãy các nguyên tố nhưng mà nguyên tử của chúng được xếp theo chiều năng lượng điện hạt nhân tăng cao và bao gồm cùng số lớp electron.
Số lớp electron = STT của chu kỳ.
Bảng tuần hoàn chất hóa học gồm tất cả 7 chu kỳ, trong đó có những chu kỳ nhỏ dại là chu kỳ 1, 2, 3, các chu kỳ lớn là 4, 5, 6, 7.
Chu kỳ 1: tất cả 2 nhân tố là He cùng H, có một lớp electron vào nguyên tử. Điện tích phân tử nhân tăng trường đoản cú H 1+ cho tới He 2+.
Chu kỳ 2: 8 nhân tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ bỏ Li 3+ tới Ne là 10+.
Chu kỳ 3: gồm 8 yếu tắc từ nhân tố Na đến Ar, tất cả 3 lớp electron trong nguyên tử và điện tích hạt nhân tăng từ na 11+ cho nguyên tố Ar là 18+.
Chu kỳ 4, chu kỳ luân hồi 5: đối với cả 2 chu kỳ, từng chu kỳ đều phải sở hữu 18 nguyên tố, bước đầu là kim loại kiềm K là 19+ với Rb là 37+, kết thúc là một khí hi hữu Xe là 54+ cùng Kr là 36+.
Chu kỳ 6: ban đầu từ sắt kẽm kim loại kiềm Cs là 55+ và xong là khí hiếm Rn là 86+. Gồm 32 nguyên tố,
Chu kỳ 7: chưa được hoàn thành.
2.3. đội nguyên tố
Vậy bảng tuần trả hóa học có bao nhiêu nguyên tố? với được chia thành các nhóm cố nào?
Bảng tuần hoàn hóa học gồm 118 nguyên tố, gồm những nguyên tố từ là 1 (Hidro) đến 118 (Oganesson). Nhóm các nguyên tố nhưng nguyên tử có số electron lớp bên ngoài cùng bằng nhau và do bao gồm tính chất tương tự như nhau được xếp theo hướng tăng của điện tích hạt nhân nguyên tử.
Số vật dụng tự của nhóm nguyên tố bằng số electron phần ngoài cùng của nguyên tử.
Ta chia thành 2 các loại nhóm nguyên tố là đội nguyên tố A với nhóm B:
Nhóm A: Gồm các nguyên tố p. Và s. Số nhóm A bằng tổng số electron phần bên ngoài cùng.
Nhóm B: Gồm những nguyên tố f và d có thông số kỹ thuật electron nguyên tử thì tận thuộc sẽ ngơi nghỉ dạng (n-1) dxnsy
+ giả dụ (x+y) = 3 -> 7 thì nguyên tố sẽ xét thuộc team (x+y)B.
+ yếu tố thuộc team VIIIB giả dụ (x+y) = 8 -> 10.
+ thành phần thuộc đội (x+y-10)B giả dụ (x+y) > 10 thì
3. Ý nghĩa bảng tuần hoàn hóa học
Dựa vào bảng tuần trả hóa học, ta rất có thể biết địa chỉ của nguyên tố và suy đoán ra tính chất của yếu tắc và kết cấu nguyên tử.
Ví dụ: thành phần A với số hiệu nguyên tử 17, thuộc team VIIA, vào chu kì 3.
Nguyên tố A tất cả số hiệu nguyên tử là 17, cần điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A gồm 17 electron.
Nguyên tố A đội VIIA nên rất có thể suy ra lớp ngoài cùng có 7e, nghỉ ngơi chu kì 3 đề xuất nguyên tử A có 3 lớp electron.
Tính phi kim của nhân tố A yếu hơn nguyên tố bên trên nó cùng nhóm (nguyên tố F tất cả số hiệu nguyên tử 9), mạnh bạo hơn nhân tố trước nó trong cùng 1 chu kì (S gồm số hiệu 16) với nguyên tố đứng bên dưới nó trong cùng nhóm (Br có số hiệu nguyên tử 35). Vì ở đoạn gần cuối chu kì 3 buộc phải nguyên tố A là một trong những phi kim mạnh.
Bảng tuần hoàn chất hóa học giúp họ biết cấu trúc nguyên tử của nguyên tố có thể suy ra vị trí và tính chất nguyên tố ấy.
Ví dụ: yếu tắc Y gồm điện tích phân tử nhân là 11+, phần bên ngoài cùng có một electron, 3 lớp electron
Vì thành phần Y tất cả điện tích phân tử nhân là 11+, 3 lớp electron và có 1e ở lớp bên ngoài cùng, đề nghị nguyên tố Y sống chu kì 3, ô 11, nhóm IA.
→ nhân tố Y là sắt kẽm kim loại vì nó ở đầu chu kỳ.
4. Bảng tuần hoàn hóa học Mendeleev
Bảng tuần hoàn hóa học đầy đủ còn theo luồng thông tin có sẵn đến tên thường gọi là bảng tuần hoàn chất hóa học Mendeleev.
Bảng nguyên tố chất hóa học lớp 8
Bước vào lịch trình Hóa học lớp 8, Bộ giáo dục đào tạo và huấn luyện cho học sinh tiếp xúc với một trong những vấn đề liên quan đến bảng tuần hoàn. Điều này góp học sinh rất có thể làm quen thuộc được điều căn bản, đọc được bản chất của vấn đề. Một vài điều mà học viên sẽ được tiếp cận là:
Nguyên tử
Nguyên tố hóa học
Bảng tuần hoàn hóa học lớp 9:
Với Hóa 9, học sinh sẽ được chiếc nhìn bao hàm về bảng tuần hoàn hóa học. Qua loa 1 số kỹ năng và kiến thức về bảng tuần hoàn hóa học, có có:
Nguồn gốc
Nguyên tắc sắp đến xếp các nguyên tố
Cấu tạo
Sự thay đổi tính chất các nguyên tố
Ý nghĩa của bảng tuần hoàn

https://toanhoc.org/wp-content/uploads/2020/08/Bang-tuan-hoan-hoa-hoc-4.jpg
Alt: Lớp 9 bảng tuần trả hóa học
Bảng nguyên tố chất hóa học lớp 10:
Sau khi đã được gia công quen với bảng tuần hoàn các nguyên tố chất hóa học thì lúc lên lớp 10, đòi hỏi học sinh đề xuất nắm chắc kỹ năng thật chắc. Trong hóa học 10, bảng tuần trả hóa học hầu hết chỉ đi sâu rộng về: bắt đầu về sự phạt minh, phương pháp sắp xếp những nguyên tố, cấu tạo bảng tuần hoàn, bài rèn luyện nâng cao, cơ bản.
5. Chế độ sắp xếp những nguyên tố vào bảng tuần hoàn
Trong bảng tuần trả hóa học, những nguyên tố sẽ được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
6. Cách đọc bảng tuần trả hóa học
Để học viên sử dụng bảng tuần hoàn một cách dễ dàng, hãy xem phương pháp đọc bảng tuần trả hóa học bên dưới đây:
+ Số nguyên tử: Còn mang tên gọi không giống là số proton của yếu tố hóa học. Đây là số proton search thấy trong phân tử nhân của một nguyên tử. Là số điện tích hạt nhân. Số nguyên tử giúp khẳng định được nhất 1 yếu tắc hóa học.
+ Nguyên tử khối trung bình: Nguyên tử khối của những nguyên tố tất cả đồng vị là số NTK vừa phải của hỗn hợp các đồng vị, tính cho tỷ lệ xác suất số nguyên tử tương ứng.
+ Độ âm điện: Là năng lực hút electron của nguyên tử lúc tạo liên kết hóa học. Khi độ âm điện của nguyên tử nhân tố càng lớn thì tính phi kim càng mạnh dạn và ngược lại
+ thông số kỹ thuật electron: cho thấy thêm phân bố những electron vào lớp vỏ nguyên tử ở trạng thái năng lượng khác nhau.
+ Số oxi hóa: Số thoái hóa là số áp cho một hay nhóm nguyên tử. Nhờ bao gồm số thoái hóa mà bọn họ nhận hiểu rằng số electron trao đổi khi 1 chất bị lão hóa hoặc bị khử.
+ thương hiệu nguyên tố: là 1 trong chất chất hóa học tinh khiết, gồm 1 kiểu nguyên tử, được rõ ràng bởi số hiệu nguyên tử, là số lượng proton có trong phân tử nhân.
+ ký hiệu hóa học: là tên viết tắt của 1 nguyên tố chất hóa học trong bảng tuần trả hóa học.
7. Bí quyết nhớ bảng tuần hoàn các nguyên tố hóa học
7.1. Ghi lưu giữ bảng tuần hoàn hóa học bằng cách truyền thống
Nhận biết các thành phần của từng nguyên tố: Khi sử dụng bảng tuần trả hóa học, chúng ta đọc phải ghi nhận được số nguyên tử, nguyên tử khối trung bình, cấu hình electron, độ âm điện, số oxi hóa, thương hiệu nguyên tố, ký kết hiệu hóa học. Tất cả đều phải có trong ô nhân tố của bảng tuần hoàn.
Học vài nguyên tố từng ngày: Đây là 1 cách học được nhiều học sinh áp dụng. Đối cùng với bảng tuần hoàn có không ít nguyên tố khó khăn nhớ và các thông số thì việc phân nhỏ tuổi ra nhằm học nó góp não ghi nhớ được một phương pháp lâu dài.
Dán những bảng tuần hoàn hóa học tại địa điểm dễ quan sát thấy
Làm thẻ ghi chú cho từng nguyên tố. Bí quyết làm này y như làm một tập flashcard.
7.2. Dùng phương thức ghi lưu giữ bảng tuần trả hóa học
7.2.1. Theo dãy hoạt động hóa học của kim loạiChắc hẳn bạn nào cũng nhớ một lời nói quen thuộc: “Khi nào nên may áo liền kề sắt lưu giữ sang phố hỏi shop Á Phi Âu”. Đây là câu nói để ghi lưu giữ 16 nguyên tố chất hóa học trong dãy hoạt động hóa học tập của kim loại. Dãy vận động hóa học của kim loại bao gồm: Na, F, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
Xem thêm: Tin game mobile hay nhất hiện nay, tin game mobile hay nhất
7.2.2. Theo bài bác ca hóa trịViệc ghi lưu giữ theo bài xích ca hóa trị cũng là một cách ghi ghi nhớ bảng tuần hoàn hóa học. Những em học sinh có thế tham khảo bài ca hóa trị dưới đây nhé!
Trên đây là cục bộ những lý thuyết cơ bản cần nắm vững về bảng tuần trả hóa học. Để có thể làm giỏi bài tập, các em cần nắm chắc hẳn và ghi nhớ bảng tuần hoàn này. Mong ôn thi đạt được tác dụng tốt, những em học sinh hoàn toàn có thể truy cập tức thì vào nền tảng học online Vuihoc.vn để rất có thể đăng ký tài khoản hoặc liên hệ nhanh qua trung tâm cung ứng của VUIHOC nhằm ôn tập được thật nhiều kỹ năng nhé!
Bảng tuần trả nguyên tố hóa học gồm vai trò cực kỳ quan trọng. Nếu những em ao ước học tốt môn Hóa, thì cần phải “tinh thông” triết lý có vào bảng tuần hoàn. Vậy, biện pháp đọc và phương pháp ghi ghi nhớ bảng tuần hoàn hóa học lớp 8, lớp 9, lớp 10 như vậy nào? nhanluchungvuong.edu.vn Education sẽ ra mắt đến những em vớ tần tật về bảng tuần hoàn những nguyên tố hóa học qua bài viết sau.

Một số thông tin về bảng tuần hoàn trong chương trình lớp 10 của Mendeleev:
Khi những nguyên tố bắt đầu được kiếm tìm thấy, bảng tuần hoàn cũng trải qua không ít lần điều chỉnh. Tuy nhiên, các hình thức hiển thị cơ phiên bản vẫn được giữ nguyên như thiết kế ban đầu của Mendeleev. Giá trị chủ quản mà bảng tuần trả nguyên tố hóa học mang lại đó là khả năng phân tích đặc thù hóa học tập của một nguyên tố rõ ràng dựa vào vị trí trong bảng. Ngoài việc được áp dụng khi tham gia học Hóa, bảng tuần hoàn cũng khá được sử dụng vào 2 môn Lý với Sinh.Cách xem bảng tuần trả hóa học

Cấu sinh sản bảng tuần hoàn các nguyên tố hóa học
Ô nguyên tố: Thể hiện các thông tin về số hiệu nguyên tử, cam kết hiệu hóa học, thương hiệu nguyên tố, nguyên tử khối của nguyên tố hóa học trong ô.Chu kỳ: Dãy những nguyên tố hóa học được xếp theo chiều tăng nhiều về điện tích hạt nhân và những nguyên tử của chúng có cùng số lớp electron. Có tất cả 7 chu kỳ trong bảng tuần hoàn nguyên tố hóa học, chu kỳ luân hồi 1, 2, 3 gọi là chu kỳ luân hồi nhỏ, chu kỳ 4, 5, 6, 7 gọi là chu kỳ luân hồi lớn.Nhóm nguyên tố: Tập hợp những nguyên tố có tính chất tương bốn nhau do trong nguyên tử của chúng gồm cùng số electron lớp ngoài cùng và được xếp thành cột theo chiều tăng nhiều của điện tích hạt hiền lành dưới lên trên.Chi ngày tiết của một ô nhân tố trong bảng tuần hoàn nguyên tố hóa học
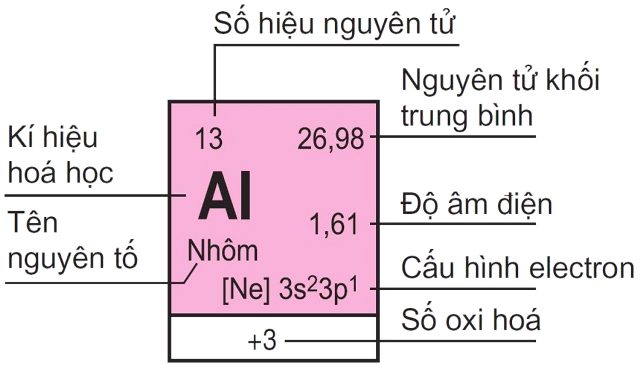
Để việc xem bảng tuần hoàn hóa các nguyên tố chất hóa học lớp 10 tiện lợi và chuẩn chỉnh xác, các em yêu cầu làm quen thuộc với một vài thuật ngữ như bên dưới:
Số hiệu nguyên tử: Còn có tên gọi khác là số proton của nhân tố hóa học. Danh từ bỏ này biểu hiện cho số proton của một nguyên tử cùng số năng lượng điện của phân tử nhân. Số hiệu nguyên tử có mức giá trị thông qua số electron vào một nguyên tử trung hòa về điện. Đặc biệt, số hiệu nguyên tử để giúp đỡ xác định duy nhất một yếu tắc hóa học. Nguyên tử khối trung bình: Hầu hết, những nguyên tố hóa học đa số là hỗn hợp của rất nhiều đồng vị khác nhau, gồm tỉ lệ phần trăm số nguyên tử xác định. Do đó, nguyên tử khối của những nguyên tố này sẽ tiến hành tính bởi nguyên tử khối mức độ vừa phải của hỗn hợp đồng vị dựa trên tỉ lệ phần trăm của những nguyên tử tương ứng.Cấu hình electron: Cho thấy sự phân bố của các electron ở các trạng thái năng lượng không giống nhau trong lớp vỏ nguyên tử hoặc ở đông đảo nơi mà bọn chúng hiện diện.Độ âm điện: Là tài năng hút electron trong quá trình tạo thành liên kết hóa học. Về phần này, các em yêu cầu ghi đừng quên độ âm năng lượng điện tỉ lệ thuận với tính phi kim. Vắt thể, giả dụ độ âm năng lượng điện của yếu tố càng lớn, tính phi kim càng táo bạo và ngược lại. Số oxi hóa: Là số sử dụng cho một hoặc 1 nhóm nguyên tử. Nhờ vào con số này, các em có thể tính được số electron dàn xếp khi tham gia phản ứng.Tên nguyên tố: Gồm 1 vẻ bên ngoài nguyên tử duy nhất, được phân biệt dựa vào số hiệu nguyên tử.Ký hiệu hóa học: là tên gọi viết tắt của nhân tố hóa học, gồm một hoặc 2 vần âm Latin. Chữ thứ nhất thường vẫn viết hoa.Ancol Isopropylic Là Gì? đặc thù Lý Hóa Và cách làm Ancol Isopropylic
Vị trí của oxi vào bảng tuần hoàn hóa học

Oxi có thông số kỹ thuật là 1s22s22p4
Vậy địa điểm của oxi trong bảng tuần hoàn chất hóa học là nghỉ ngơi ô vật dụng 8; chu kỳ luân hồi 2 (do gồm 2 lớp electron); team VIA (do 6 e hóa trị, nhân tố p)
Ý nghĩa của bảng tuần hoàn nguyên tố hóa học
1. Lúc biết được vị trí của nguyên tố hóa học, ta có thể suy ra được tính chất và kết cấu của nguyên tố chất hóa học đó.
Ví dụ: lúc biết nguyên tố X gồm số hiệu nguyên tử là 16, thuộc chu kỳ 3, đội VIA, ta có thể suy ra được:
Điện tích phân tử nhân của yếu tắc X là 16+ với nguyên tố này có 16 electron (số hiệu nguyên tử là 16)Nguyên tố X gồm 3 lớp electron (thuộc chu kỳ luân hồi 3).Lớp xung quanh cùng của nguyên tố X tất cả 6 electron (thuộc nhóm VIA).2. Lúc biết được cấu tạo nguyên tử của nguyên tố hóa học, ta hoàn toàn có thể suy ra được đặc điểm và địa điểm của nguyên tố hóa học kia trong bảng tuần trả nguyên tố hóa học.
Ví dụ: lúc biết nguyên tố Y có điện tích hạt nhân là 12+, bao gồm 3 lớp electron và lớp bên ngoài cùng tất cả 2 electron, ta rất có thể suy ra được:
Nguyên tố Y nằm ở ô trang bị 12 (điện tích hạt nhân là 12+), thuộc chu kỳ luân hồi 3 (có 3 lớp electron), team IIA (lớp ko kể cùng có 2 electron) ở bảng tuần hoàn.Do nằm tại đầu chu kỳ, yêu cầu nguyên tố Y là kim loại.Cách học thuộc cấp tốc bảng tuần hoàn hóa học
Thực tế, bảng tuần hoàn những nguyên tố hóa học 10 có không ít thông tin. Hãy áp dụng một trong 3 cách sau để việc học thuộc cùng ghi ghi nhớ trở nên đơn giản dễ dàng và nhanh chóng hơn.
Cách 1: nghiên cứu bảng tuần hoàn
Mỗi ô trong bảng tuần hoàn sẽ hiển thị thông tin về tên, ký kết hiệu, số hiệu nguyên tử. Chỉ việc ghi lưu giữ 10 yếu tắc đầu tiên, các em vẫn tìm ra quy luật cho những nguyên tố còn lại.
Cách 2: In cùng dán bảng tuần hoàn ở mọi nơi dễ phân biệt trong không gian học

Các em hãy dán bảng tuần hoàn ở hồ hết nơi dễ quan gần kề và chia thành nhiều phần nhằm học. Điều này thiệt sự sở hữu đến tác dụng cao trong câu hỏi ghi nhớ.
Cách 3: Dùng cách thức để ghi nhớ
Để rất có thể nhớ lâu kỹ năng và kiến thức trong bảng tuần hoàn, các em cần liên tục làm bài tập và áp dụng câu thơ/văn xuôi để ghi nhớ:
Hơn hết, để hoàn toàn có thể nhớ lâu kiến thức trong bảng tuần hoàn nguyên tố hóa học, những em cần tiếp tục làm bài tập và áp dụng câu thơ/văn xuôi nhằm ghi nhớ đôi mươi nguyên tố đầu:
Ancol Là Gì? phương pháp Chung, tính chất Và cách Nhận Biết
Hoàng hôn lặn bể Bắc
Chợt nhớ sống phương Nam
Nắng mai ánh sương phủ
Song cửa ngõ ai ko cài.
| HHoàng | He Hôn | ||||||
| Li Lặng | Be Bể | BBắc | CChợt | NNhớ | OỞ | FPhương | Ne Nam |
| Na Nắng | Mg Mai | AlÁnh | Si Sương | PPhủ | SSong | Cl Cửa | Ar Ai |
| KKhông | Ca Cài |
Hoặc một vài câu nói học thuộc như: “khi nào cần may áo liền kề sắt nhớ sang phố hỏi shop Á Phi Âu” tương xứng cho F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. “Lâu ni không đàng hoàng coi phim” khớp ứng với Li, Na, K, Rb, Cs, Pr.
Cách 4: bài ca hóa trị
Áp dụng bài ca hóa trị nhằm học trực thuộc bảng tuần hoàn những nguyên tố hóa học:
“Kali, I – ốt, Hidro
Natri cùng với Bạc, Clo một loài
Là hóa trị 1 chúng ta ơi
Nhớ ghi mang lại rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cùng tương đương Bải
Cuối thuộc thêm chú Oxi
Hóa trị 2 ấy có gì nặng nề khăn
Bác Nhôm hóa trị 3 lần
Ghi sâu tâm trí khi cần phải có ngay
Cacbon, Silic này đây
Là hóa trị 4 ko ngày nào quên
Sắt kia kể cũng quen tên
2, 3 tăng lên và giảm xuống thật phiền lắm thôi
Nito băn khoăn nhất đời
1, 2, 3, 4 lúc thời máy 5
Lưu huỳnh lắm lúc tập luyện khăm
Xuống 2, lên 51 khi nằm sản phẩm 4
Photpho nói tới không dư
Nếu ai hỏi mang đến thì hừ rằng 5
Em ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần”.
Bảng tuần hoàn hóa học rõ nét, không hề thiếu nhất
Để giúp những em hoàn toàn có thể học tập hiệu quả, nhanluchungvuong.edu.vn Education đã tổng hợp những file pdf, file hình ảnh bảng tuần hoàn chất hóa học rõ nét, không thiếu thốn nhất lớp 8, lớp 9, lớp 10 dưới đây. Những em có thể tải bảng tuần hoàn chất hóa học về nhằm học tập cùng ghi nhớ:

Bài tập vận dụng có đáp án
Bài tập SGK Hóa 9
Bài 1 Trang 101 SGK Hóa 9Nêu cấu tạo nguyên tử, đặc thù kim một số loại và đặc thù phi kim của những nguyên tố gồm số hiệu nguyên tử thứu tự là 7, 12, 16.
Lời giải:
Gọi A, B, C là 3 nguyên tố có số hiệu nguyên tử theo yêu ước đề bài, dựa trên bảng yếu tắc hóa học, ta tất cả bảng sau:
| Nguyên tố | Số hiệu nguyên tử | Cấu tạo nguyên tử | Tính chất | ||||
| Điện tích phân tử nhân | Số e vào nguyên tử | Số lớp electron | Số e lớp bên ngoài cùng | Kim loại | Phi kim | ||
| A | 7 | 7+ | 7 | 2 | 5 | x | |
| B | 12 | 12+ | 12 | 3 | 2 | x | |
| C | 16 | 6+ | 6 | 3 | 6 | x |
Cho biết yếu tố X có cấu trúc nguyên tử với năng lượng điện hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có một electron. Xác định vị trí của nguyên tố X vào bảng tuần hoàn.
Lời giải:
Vị trí của nguyên tố X vào bảng tuần hoàn:
Ô số 11 (điện tích phân tử nhân là 11+)Chu kì 3 (3 lớp electron)Nhóm I (lớp không tính cùng có một electron)Từ 3 tin tức trên, ta có thể kết luận:
Tên nguyên tố X là Natri.Ký hiệu hóa học là Na.Nguyên tử khối là 23.Bài 3 Trang 101 SGK Hóa 9Đặc điểm của những nguyên tố thuộc nhóm I hồ hết là những sắt kẽm kim loại mạnh giống như Natri (có khả năng tác dụng với nước tạo thành thành dung dịch kiềm hóa giải khí hidro, chức năng với oxi sinh sản thành oxit, công dụng với phi kim khác sinh sản thành muối). Hãy viết 3 phương trình phản bội ứng minh họa với Kali.
Lời giải:
Kali công dụng với nước chế tác dung dịch kiềm với giải phóng khí hidro.2K + 2H2O → 2KOH + H2
Kali chức năng với oxi chế tạo ra thành oxit.4K + O2 → 2K2O
Kali tác dụng với phi kim chế tạo thành muối.2K + Cl2 → 2KCl
Bài 4 Trang 101 SGK Hóa 9Đặc điểm của các nguyên tố thuốc đội VII gần như là đông đảo phi kim mạnh giống như Clo (trừ At) (có khả năng công dụng với số đông kim các loại tạo thành muối, tác dụng với hidro tạo thành hợp hóa học khí). Hãy viết 3 phương trình bội nghịch ứng minh hoạ cùng với Brom.
Lời giải:
Brom công dụng với kim loại tạo thành muối.Br2 + 2K → 2KBr
3Br2 + 2Fe → 2Fe
Br3
Br2 + H2 → 2HBr (k)
Bài 5 Trang 101 SGK Hóa 9Hãy cho biết thêm cách thu xếp nào sau đây đúng theo hướng tính kim loại giảm dần dần và phân tích và lý giải sự lựa chọn:
a. Na, Mg, Al, K
b. K, Na, Mg, Al
c. Al, K, Na, Mg
d. Mg, K, Al, Na
Lời giải:
b là câu trả lời đúng vì
Các nguyên tố Na, Mg, Al ở cùng chu kì, theo chiều tăng mạnh điện tích phân tử nhân, tính sắt kẽm kim loại giảm.Các yếu tắc Na, K ở và một nhóm, theo hướng tăng năng lượng điện hạt nhân, tính kim loại tăng.Bài tập SGK Hóa 10
Bài 1 Trang 35 SGK Hóa 10Các yếu tắc xếp sống chu kì 6 tất cả số lớp electron vào nguyên tử là:
a. 3
b. 5
c. 6
d. 7
Lời giải:
c là câu trả lời đúng.
Bài 2 Trang 35 SGK Hóa 10Trong bảng tuần hoàn những nguyên tố, số chu kì nhỏ và số chu kì phệ là:
a. 3 và 3
b. 3 cùng 4
c. 4 cùng 4
d. 4 cùng 3
Lời giải:
b là câu trả lời đúng.
Bài 3 Trang 35 SGK Hóa 10Số nhân tố trong chu kì 3 và 5 là:
A. 8 với 18
B. 18 cùng 8
C. 8 và 8
D. 18 cùng 18
Lời giải:
a là lời giải đúng.
Bài 4 Trang 35 SGK Hóa 10Trong bảng tuần hoàn, những nguyên tố được sắp xếp theo chính sách nào?
a. Theo chiều tăng của điện tích hạt nhân
b. Những nguyên tố có cùng số lớp electron vào nguyên tử được xếp thành 1 hàng
c. Các nguyên tố tất cả cùng số electron hóa trị vào nguyên tử được xếp thành 1 cột
d. Cả A, B, C
Lời giải:
d là câu trả lời đúng.
Bài 5 Trang 35 SGK Hóa 10Tìm câu sai trong các câu sau đây:
a. Bảng tuần hoàn có có các ô nguyên tố, những chu kì và các nhóm.
b. Chu kì là dãy các nguyên tố nhưng nguyên tử của chúng bao gồm cùng số lớp electron, được bố trí theo chiều năng lượng điện hạt nhấn tăng dần.
c. Bảng tuần hoàn gồm 7 chu kì. Số sản phẩm công nghệ tự của chu kì thông qua số phân lớp electron vào nguyên tử.
d. Bảng tuần hoàn gồm 8 team A và 8 nhóm B.
Lời giải:
c là đáp án đúng.
Câu đúng: Bảng tuần hoàn gồm 7 chu kì. Số máy tự của chu kì bằng số lớp electron trong nguyên tử.









